![]()
Die Tuberkulose (Tbc) entsteht durch die Infektion mit Mycobacterium tuberculosis (meist), M. africanum oder M. bovis. M tuberculosis ist ein ungewöhnlicher Erreger, der evolutionsbiologisch wahrscheinlich aus einem Vorfahren von M. bovis entstanden ist; er ko-existiert seit Jahrtausenden mit dem Menschen. Dies könnte die aussergewöhnlichen Toleranzmechanismen erklären, die dafür sorgen, dass nur wenige der infizierten Menschen manifest erkranken. Durch die ebenfalls ungewöhnliche Art der Antigenpräsentation bieten Impftsrategien bisher allenfalls einen 70%igen Schutz.
Etwa ein Drittel der Menschheit ist mit dem Erreger
infiziert, und nur ein Drittel davon haben Zugang zu adäquater medizinischer
Versorgung. 2 Millionen Menschen sterben jährlich an Tbc, die damit
nach AIDS die häufigste auf eine Infektionserkrankung zurückzuführende
Todesursache ist. Die Tatsache, dass der Erreger antibiotisch schwer zu
behandeln ist und seine Ausbreitung durch Armut gefördert wird, stellt
eine schwere Herausforderung für das Gesundheitswesen vieler Entwicklungsländer
dar.
Eine effektive (und mit ca. 1-5$ pro gewonnenem gesundem Lebensjahr
extrem günstige) Behandlung steht zwar zur Verfügung, ist jedoch
für die meisten Betroffenen unerschwinglich, und die Industrieländer
zeigen noch immer wenig Interesse, das Tuberkuloseprogramm der WHO mit
mehr finanziellen Mitteln auszustatten.
Derzeitige Inzidenz der Tbc in Deutschland 15/100.000 Einwohner pro Jahr. Trotzdem stellt die Lungentuberkulose weiterhin eine immer zu bedenkende Krankheit dar, da die Inzidenz nicht wie in den 80er Jahren prognostiziert abgelaufen ist. Gründe hierfür sind u.a. die AIDS-Epidemie, Einwanderung aus Ländern der 2. und 3. Welt sowie Alkoholismus (s. Kasten).
 |
 |
|
 |
 |
|
! Erhöhtes Tbc-Risiko durch Resistenzminderung bei:
|
Klinik
Es gibt keine spezifische Klinik der Tuberkulose. Hinter
praktisch jeder Lungenerkrankung kann sich eine Tuberkulose verbergen.
Die primäre, d.h. im Anschluss an die Erstinfektion
auftretende Tbc, ist bei der überwiegenden Zahl der Betroffenen asymptomatisch
oder wird als grippaler Infekt verkannt. Die meisten Patienten erkranken
erst später an einer postprimären Tbc.
Primär-Tbc
5–6 Wochen nach Infektion bildet sich der Primärherd aus, welcher histologisch einem Granulom aus Epitheloidzellen und Langhansschen Riesenzellen mit zentraler Verkäsung entspricht. Durch lymphogene Ausbreitung greift die Infektion auf den dazugehörigen regionalen Lymphknoten über. Der Primärherd und der »mitreagierende« Lymphknoten (bei pulmonaler Tbc: meist Hilus-LK) wird als Primärkomplex bezeichnet. Beide heilen über Wochen und Monate meist vollständig aus, wobei sie jedoch oft vernarben und verkalken und somit persistierende radiologische Spuren hinterlassen (kalkdichte Rundschatten typischerweise in den Lungenspitzen).
! Auch wenn der Primärkomplex klinisch »abgeheilt« ist, überleben Tuberkelbazillen in mindestens 20% in dem betroffenen Gewebe, und können bei Immunschwäche eine Reinfektion auslösen (s. postprimäre Tbc). |
Der Primärherd liegt meist in der Lunge (90%), und hier meist subpleural oder in den Lungenoberfeldern. Selten kann er in Tonsillen oder im Magen-Darm-Trakt liegen.
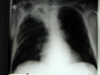
Im Rö-Thorax zeigt sich der Primärkomplex
(solange er noch nicht ausgeheilt ist) meist nur durch den (einseitig)
geschwollenen Hiluslymphknoten, der parenchymale Primärherd ist nur
selten zu sehen und zeigt sich dann als lokale Verschattung.
Der geschwollene Hiluslymphknoten kann einen zuführenden Bronchus
komprimieren, wodurch eine Atelektase entsteht (meist im Mittellappen,
sog. Mittellappen-Syndrom).
! Differentialdiagnostisch muß bei geschwollenen Hilus-LK an ein Bronchial-Ca, Metastasen, ein malignes Lymphom oder eine Sarkoidose gedacht werden. |
In der Regel ist das »Auf- und Abblühen« eines Primärkomplexes die einzige Manifestation der Primär-Tbc, das der Patient selbst in der Regel jedoch nicht wahrnimmt. Seltener tritt Fieber, Husten oder Nachtschweiß auf, und die Erkrankung wird dann als Grippe fehlgedeutet. Ein Erythema nodosum kann auftreten.
Als Ausdruck der Immunreaktion des Körpers entwickelt sich mit der Ausbildung des Primärkomplexes eine positive und meist lebenslang persistierende Tuberkulinreaktion (»Hautkonversion« ).
Bei einer Minderheit der Infizierten heilt der Primärkomplex nicht aus und die Primär-Tbc verläuft kompliziert; solche Verläufe treten z.B. bei Säuglingen und Kleinkindern auf oder sind Folge einer schweren Immunschwäche oder einer großen Zahl und Virulenz des Erregers. Folgende komplizierten Verläufe sind möglich:
- Lokale Ausbreitung: die Primärläsion kann sich ausbreiten und endobronchial in andere Lungenteile gelangen und dort Pneumonien, Atelektasen, Bronchialverengungen oder Bronchiektasen verursachen
- Hämatogene Ausbreitung: hierdurch entsteht meist eine Pneumonie, es kann jedoch auch zur Miliar-Tbc kommen
- Lymphogene Ausbreitung: hierdurch können andere Lymphknoten befallen werden, so dass eine bisweilen ausgedehnte Lymphknoten-Tbc entsteht.
! Komplikationen der Primär-Tbc Miliartuberkulose Sie entspricht der hämatogenen bzw. lymphohämatogenen
Streuung von Tuberkelbazillen aus dem Primärkomplex in verschiedene
Organe, meist in die Lunge. Sie tritt v.a. in den ersten 6 Monaten
nach Inkubation als Komplikation der Primär-Tbc auf, meist
bei Säuglingen und Kindern bzw. immungeschwächten Erwachsenen.
Beginn der Erkrankung ist meist akut, oft mit hohem Fieber und schwerem
Krankheitsgefühl. Pleuritis exsudativa Eine Pleuritis exsudativa entsteht meist per continuitatem aus pleuranahen Herden, seltener entwickelt sie sich hämatogen. Sie tritt (seltener) auch im Rahmen einer postprimären Tbc auf. Die Diagnose kann durch eine Pleurapunktion gestellt werden, die ein Exsudat mit erniedrigtem Zuckergehalt und erhöhten Adenosin-Desaminasen (ADA) zeigt. Tuberkelbakterien lassen sich jedoch nur selten nachweisen. Landouzy-Sepsis Bei geschwächter Immunabwehr droht die meist tödliche Landouzy-Sepsis, eine septisch verlaufende Primär-Tuberkulose. |
Postprimär-Tbc
Als Postprimär-Tbc (chronische Tbc) wird jede Form
der Tbc bezeichnet, die auftritt, wenn sich bereits eine Immunität
gegen Mykobakterien ausgebildet hat (dies ist an einem positiven Tuberkulintest
erkennbar). Sie tritt damit frühestens 5–6 Wochen nach Primärinfektion
auf. In aller Regel ist die Postprimär-Tbc allerdings ein spätes
Ereignis: nur in 5% tritt sie in den ersten 2 Jahren nach Infektion auf.
In der Regel ist die Postprimär-Tbc auf eine Reaktivierung
einer durchgemachten Primär-Tbc zurückzuführen; zu einer
solchen endogenen Reinfektion kommt es häufig bei Resistenzminderung.
Seltener ist die Superinfektions-Tbc, die eine exogene
Reinfektion darstellt und bei Immunsupprimierten klinisch wie eine Postprimär-Tbc
verlaufen kann (bei Immunkompetenten frischt die Reinfektion in der Regel
lediglich die Immunität wieder auf).
Die chronische Lungen-Tbc ist meist die Folge einer
hämatogenen oder lymphogenen Aussaat vom ehemaligen Primärkomplex
in andere Lungenteile. Sie zeigt sich vor allem durch apikale Herde, weil
die in den Lungenspitzen höhere Sauerstoffspannung eine Vermehrung
der Bazillen fördert. Im Röntgenbild zeigen sich als erster
Hinweis auf eine Reaktivierung unscharfe kleine, infra- oder supraklavikuläre
Flecken (»Simonsche Spitzenherde«) oder ein
ausgedehnteres »weiches«, ebenfalls infra- oder supraklavikulär
gelegenes »Assmann« - Frühinfiltrat.
Diese Reaktivierungsherde heilen unter spezifischer Therapie meist ab.
Der weitere Verlauf ist gekennzeichnet durch eine langsame Ulzeration
des Reaktivierungsherdes, der nun Anschluß an einen Ableitungsbronchus
finden kann und damit die endobronchiale Ausstreuung einleitet.
Tuberkelbakterien sind nun im Sputum mit hoher Wahrscheinlichkeit nachweisbar:
der Patient (bzw. die Tbc) ist »offen« und damit
potentiell infektiös.
Über Jahre kann es durch endobronchiale Ausbreitung zur Zerstörung
und Kavernisierung immer grösserer Lungenanteile kommen. Bei Arrosion
einer Bronchialarterie treten Hämoptysen (Bluthusten) bis hin zum
früher oft tödlichen »Blutsturz« (Hämoptoe)
auf. Eine weitere seltene Komplikation ist der Pneumothorax. Selten kann
der Kehlkopf oder gar der Magen-Darmtrakt durch endoluminale Streuung
mit einbezogen werden.
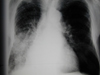
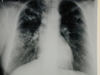
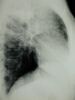
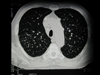
! Oberlappen-Tbc mit Kavernenbildung. Die beiden Schichtaufnahmen zeigen einen Tbc-Herd im rechten Oberlappen. Durch entzündliche Einschmelzung des Lungengewebes bilden sich Kavernen, deren Wände durch Kalkeinlagerungen im Röntgenbild sichtbar werden. |
Extrapulmonale Tuberkulose
Tbc kann jedes Organsystem betreffen und eine Vielfalt von Symptomen auslösen. Meist ist die extrapulmonale Tbc das Resultat einer lymphohämatogenen Verbreitung einer pulmonalen Tbc, seltener handelt es sich um eine Primärläsion. Kleinkinder und immungeschwächte Patienten (z.B. AIDS) sind häufiger von extrapulmonalen Formen betroffen:
- Nebenniere: meist beidseitig, früher häufige Ursache des M. Addison (Nebennierenrindeninsuffizienz)
- ZNS: z.B. tuberkulöse Meningitis; der Liquorbefund zeigt typischerweise eine Eiweißerhöhung, eine mittelgradige Zellvermehrung (»Pleozytose« mit ca 100–500/3 Zellen, überwiegend Lymphozyten) und einen stark erniedrigten Liquorzucker
- Knochen und Gelenke: in der Wirbelsäule sind typischerweise je 2 Vertebrae betroffen (Spondylitis tuberculosa). Die Diagnose wird mittels CT oder konventioneller Tomographie gestellt. Eine Sonderform ist der Senkungsabszeß: im Knochen entstehender Abszeß, der durch die Eigenschwere des Eiters entlang vorbestehenden Bahnen absinkt (meist als Iliopsoasabszess).
- Niere: eine Nierenbeteiligung tritt frühestens 5 Jahre nach Infektion auf und kann sich über die Ureteren zu Blase und Geschlechtsorganen ausbreiten. Typisch ist eine Hämaturie mit steriler Pyurie. Die Diagnose wird durch Urinkultur und Ausscheidungsurogramm gestellt
- Perikard: Erguß, konstriktive Perikarditis
- Darm: Erbrechen und Durchfall, Gewichtsverlust
- Lymphknoten: Die Lymphknoten-Tbc tritt fast immer als Komplikation der Primär-Tbc auf. Betroffen sind oft Halslymphknoten (auch durch M. bovis bedingt, z.B. in unpasteurisierter Milch) oder es besteht eine generalisierte Lymphadenopathie. Eine solche macht meist eine Lymphknotenexstirpation erforderlich, um ein malignes Lymphom auszuschließen.
! Aktivitätszeichen der Lungen-Tbc Folgende Zeichen weisen auf eine aktive Tbc-Infektion hin:
|
Therapie
Eine Heilung wird unter idealen Umständen in ³
97% erreicht! Jede aktive Tbc ist behandlungspflichtig.
Um eine Resistenzentwicklung zu verhindern, muß immer
eine Kombinationsbehandlung von 3–4 Antituberkulotika initiiert
werden. Weil erhebliche und z.T. irreversible Nebenwirkungen auftreten
können, ist es sicherer, die Behandlung unter stationären Bedingungen
einzuleiten (insbesondere bei offener Lungentuberkulose, bei schweren
Zweiterkrankungen und bei Patienten aus schwierigen sozialen Verhältnissen).
Die Therapie muß über mehrere Monate fortgesetzt werden und
sollte auch im ambulanten Bereich von Gesundheitspersonal überwacht
werden (direct observed therapy-DOT).
Bei hochresistenten Tuberkulosestämmen ist auch Linezolid häufiger
hoch wirksam (auch wenn es für diese Indikation nicht zugelassen
ist).
Atypische Mykobakteriosen
Infektionen durch nicht-tuberkulöse Mykobakterien, mit klinisch teilweise ähnlichem Verlauf. Die atypischen Mykobakterien werden nicht von Mensch zu Mensch, sondern meist durch Umweltkontakt übertragen.
! Die atypischen Mykobakterien sind relativ apathogen und verursachen daher bei immunkompetenten Patienten nur selten eine Infektion. |
Klinik
Extrem variabel, extrapulmonale Formen sind häufig. Evtl. besteht Fieber, Husten, Abgeschlagenheit sowie chronische Diarrhoe und Lymphadenopathie. Betroffen sind v.a. Lunge, Lymphknoten, Haut, GI-Trakt, Leber und Milz.
Erreger
- Häufigste Erreger: M. avium und M. intrazellulare, die aufgrund der schwierigen Unterscheidbarkeit oft zum MAI-Komplex (Mycobakterium avium intrazellulare-Komplex) zusammengefasst werden. Vorkommen v.a. bei AIDS-Patienten.
- Seltenere Erreger: M. Kansasii, marinum, fortuitum, scrofulaceum, abscessus, chelonae, ulcerans. Diese Erreger kommen ubiquitär vor und sind normalerweise nicht pathogen, können jedoch bei zellulärer Immunschwäche eine opportunistische Infektion verursachen.
Diagnostisches Vorgehen
Die Erreger können in Blut (v.a. MAI-Komplex), Stuhl, Urin, Sputum, durch bronchoalveoläre Lavage oder Biopsien nachgewiesen werden.
Therapie
Die Behandlung ist schwierig wegen der Resistenz der atypischen Mykobakterien gegen Isoniazid und andere Tbc-Medikament. Infrage kommen Dreifach-Kombinationen, je nach Erreger mit Clarithromycin, Ethambutol, Rifabutin, Amikacin und/oder Chinolonen.