![]()
Akute respiratorische Insuffizienz im Rahmen eines Schockgeschehens mit disseminierten interstitiellen Lungenveränderungen.
(Untaugliche) Synonyma sind: Schocklunge, hyalines Membran-Syndrom,
Respiratorlunge.
Das ARDS ist die schwerwiegendste Form der akuten Schädigung einer
vormals normalen Lunge; sie entsteht durch eine diffuse Entzündungsreaktion
und manifestiert sich vor allem durch Hypoxämie, bilaterale Lungeninfiltrate
und ein nicht-kardiogenes Lungenödem.
Das ARDS tritt bisweilen isoliert auf, ist jedoch oft Teil einer den ganzen
Körper betreffenden unspezifischen Entzündungsantwort mit Multiorganversagen
(systemic inflammatory response syndrome, SIRS). Die Mortalität beträgt
40–75%.
 |
Klinik
Immer schweres Krankheitsbild, das innerhalb von Stunden
zur Beatmungspflichtigkeit führen kann, jedoch auch häufig während
der Beatmung entsteht.
Klinisch tritt 12–96 h nach dem schädigenden Ereignis eine
zunehmende Dyspnoe, Tachypnoe und Hypoxämie sowie häufig ein
Multiorganversagen auf.
Die Erkrankung verläuft typischerweise in 4 Phasen (Tabelle).
| Stadien des ARDS | |
| Stadium I | Auslösendes Ereignis, keine klinischen Symptome |
| Stadium II | Hyperventilation. BGA: Hypoxämie, respir. Alkalose. Rö-Thorax unauffällig |
| Stadium III | Tachypnoe > 20/Min., Zeichen der CO2-Retention. BGA: Respir. Globalinsuff. Rö-Thorax: Interstitielles Lungenödem |
| Stadium IV | Oft therapieresistente Hypoxie durch Re-Li-Shunt, Koma, Schock, hypoxisches Herzversagen |
Komplikationen
Komplikationen sind Pneumonie und Sepsis: beide können sowohl ein
ARDS auslösen als auch im Gefolge eines ARDS entstehen. Häufig
resultiert ein Multiorganversagen mit weiterer Steigerung der Mortalität:
diese erreicht bei Versagen von 3 Organen über > 1 Woche 98%.
Ein Pneumothorax kann als Folge der wegen der Hypoxämie oft erforderlichen
Überdruckbeatmung entstehen. Atelektasen treten im Rahmen des sekundären
Surfactantmangel auf.
Auslöser
Das ARDS hat viele Auslöser; diese können die Lunge selbst betreffen oder aber primär außerhalb der Lunge liegen.
Ätiologie
- Schock jeder Genese
- Infektionenen: z.B. Sepsis, Pneumonie (in ca. 20% Ursache und in ca. 40% Komplikation eines ARDS)
- Trauma: z.B. Polytrauma, SHT, Lungenkontusion, Fettembolie, Verbrennungen
- Aspiration: z.B. von Mageninhalt, Süß- oder Salzwasser
- Inhalation: Sauerstoffüberdosierung, Rauchvergiftung
- Disseminierte intravasale Gerinnung (DIC), Massentransfusionen
- Pankreatitis, Urämie, Coma diabeticum
- Intoxikation: z.B. mit Heroin, Barbituraten, Paraquat.
Pathogenese
Die Reaktion der Lunge auf eine schwere Schädigung verläuft stereotyp in 4 Phasen:
- exsudative Phase: der auslösende Schädigungsprozeß führt zur gesteigerten Kapillarpermeabilität mit interstitiellem Lungenödem
- Einstrom neutrophiler Granulozyten: hierdurch kommt es zur Freisetzung von Sauerstoffradikalen, Proteasen und Entzündungsmediatoren
- Entzündungsreaktion mit kapillärem Leck: hieraus
resultiert ein alveoläres Lungenödem (alveolar flooding)
mit Einstrom eines proteinreichen Exsudates in die Alveolen.
Dies wiederum führt zur Inaktivierung von Surfactant, nachfolgenden Mikroatelektasen und damit zum funktionellen intrapulmonalen rechts-links-Shunt mit Hypoxie - Defektstadium mit Fibrose durch Proliferation von Fibroblasten
und Endothelzellen mit erhöhter Diffusionsstrecke und einer zunehmenden
Perfusionsverschlechterung mit respiratorischer Insuffizienz.
Eine vollständige Restitutio ad integrum ist möglich, meist verbleibt jedoch ein Defektzustand.
Diagnostisches Vorgehen
Die Diagnose stützt sich auf klar definierte Kriterien, zu denen die folgenden Zeichen gehören:
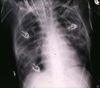
- akutes Lungenödem, welches nicht durch Linksherzversagen erklärt werden kann
- bilaterale Infiltrate im Röntgenbild (»Schmetterlingsfigur«, später »weiße Lunge«)
- schwerwiegend eingeschränkte Oxigenierung.
Diese Kriterien setzen teilweise invasive intensivmedizinische Messungen
(z.B. Swan-Ganz-Katheter) voraus.
Die wichtigsten Differentialdiagnosen sind das Linksherzversagen sowie
die Lungenembolie (bei der Embolie ist das Röntgenbild im Gegensatz
zum ARDS meist normal).
Therapie
Prinzip
- Bekämpfung der Ursachen: die auslösende Ursache wird konsequent behandelt (z.B. Schockbekämpfung, Sepsisbekämpfung, Korrektur einer disseminierten intravasalen Gerinnung)
- schonende Beatmung: der Beatmungsstrategie kommt eine entscheidende
Bedeutung zu: frühzeitige Beatmung mit PEEP (positive end-exspiratory
pressure), jedoch bei möglichst niedrigen Atemzugvolumen, um die
noch intakte Alveolarmasse nicht weiter zu schädigen.
Aus dem gleichen Grund sollte eine volle Ventilation der Lunge nicht erzwungen werden (sog. permissive Hyperkapnie: hierbei werden pCO2-Erhöhungen bis über 100 mmHg toleriert) - unterstützende Therapie durch low-dose Heparin, »Schaukelbett« (Wechsel von Bauch-, Rücken- und Seitenlagerung) Effektivität umstritten, genaue Flüssigkeitsbilanzierung mit Hilfe eines Pulmonalis-Katheters (Ziel: Vermeidung hoher zentralvenöser Gefäßdrücke); bei Pneumonie oder Sepsis kalkulierte Antibiotika-Therapie.
Glukokortikoide sind wirkungslos, werden jedoch bisweilen in Stadium III und IV gegeben. Ist ein septischer Schock Ursache des ARDS, scheint die Gabe von Hydrocortison die Prognose zu verbessern. In schweren Fällen kann die extrakorporale Membranoxygenierung (ECMO) erwogen werden.
Infektionsprophylaxe
- Grundregeln der Hygiene streng beachten: Händedesinfektion, Kaskadenluftbefeuchter verwenden, Beatmungsschläuche alle 48h wechseln, effektive und atraumatische Bronchialtoilette (»Absaugen«, möglichst bronchoskopisch). Evtl. supra-glottische Absaugung
- Erkennen von Infektionen: kontinuierliche Fiebermessung, tägl. Rö-Thorax. Bei Infektionsverdacht Monitoring der Kolonisation von Mundschleimhaut (Abstrich), Atemwegen (Trachealsekret), Katheterspitzen (Blutkultur), Dauerkatheter (Urinkultur) und Wunden (Wundabstrich)
- Antibiotikaprophylaxe: selektive Darmkontamination z.B. mit Polymixin, Tobramycin und Amphotericin B p.o. und Cephalosporin i.v. senkt die Pneumonierate und Mortalität bei chirurgischen Patienten. Die Folgen der hierdurch induzierten Resistenzentwicklung ist noch unklar (werden nicht resorbiert, Wert umstritten; Studien liegen für Postop- und Traumapatienten, nicht aber für Pat. mit multiplen internistischen Vorerkrankungen vor: diese zeigen erniedrigte Infektionsrate bei unveränderter Mortalität)
- Antibiotika: erfolgreiche Infektbehandlung ist wesentliche
Voraussetzung für eine Besserung des ARDS.
Typischen Keimwechsel im Verlauf einer Beatmungspneumonie beachten: - Initial v.a. bei ambulant erworbener Pneumonie z.B. grampositive oder »atypische« Erreger (z.B. Legionellen). Nach 3 Tagen überwiegen gramnegative Bakterien (z.B. Pseudomonas aeruginosa). Nach 7 Tagen Aspergillus fumigatus, »Selektionskeime« wie z.B. Stenotrophomonas maltophilia, hochresistente Klebsiellen oder (selten) Candida spp.
|
! Fußangeln und Fingerzeige
|